چکیده مقالات ناسا درباره نور درمانی با نور کم توان LLLT
(Low Level Light Therapy)
در این مطلب به چگونگی پیدایش LLLT، مکانیسم عمل و انواع کاربردهای آن در پزشکی از منظر ناسا خواهیم پرداخت.
در درمان با لیزر پرتوان (High level laser treatment or HLLT) از توان لیزر برای کار روی یک هدف خاص از طریق فرایند انتقال نور- گرما استفاده میشود تا تغییر فوتوترمال (Photothermal) را در درجات مختلف ایجاد کند. از HLLT در بسیاری از زمینههای جراحی از جمله جراحیهای پوستی، زیبایی یا پلاستیک استفاده میشود. از طرف دیگر، هنگامی که از لیزر یا منبع نور دیگری در سطوح کم انرژی فوتون، روی بافت استفاده میشود، انرژی از فوتونهای جذب شده مستقیماً به سلول جذبکننده یا کروموفور (Chromophore) منتقل میشود و باعث فعالسازی سلولهای هدف و نوعی تغییر در فعالیت مربوط به آنها میشود. کاربرد بالینی این فرایند (اصطلاحاً لیزر درمانی سطح پایین (LLLT) یاphotobiomodulation ) در سال 1988 توسط دانشمندانی به نامهایOhshiro و Calderhead، “photoactivation، کشف شد.

پیشرفت در سفرهای فضایی و کشف کاربردهای زمینی جدید
سفر به فضا زمینههای جدیدی برای مطالعه و دانش فراهم کرده است. پزشکی فضایی نیز در زیرشاخههای مختلفی گسترش داشته است. اداره ملی هوانوردی و فضایی ناسا (NASA or NASA Marshall Space Flight Center-SBIR) توسط دولت ایالات متحده در سال 1958 به عنوان یک برنامه فضایی غیرنظامی برای تحقیقات هوانوردی و هوافضا تأسیس شد. ورود انسان به فضا از نظر زیست شناختی، چالشهای بسیاری را به وجود آورده است. فضانوردان در محیط چالشبرانگیز فضا به سختی کار انجام میدهند. در واقع این محیط دارای میکروگرانش یا همان جاذبههای کوچک است که اثرات سوئی بر روی استخوان و عضله دارد، به طوری که احتمال آسیب اسکلتی-عضلانی را افزایش میدهد. میزان آسیبدیدگی برای فضانوردان در طی دورههای مأموریت، سه برابر بیشتر از خارج از دورههای مأموریت است. مشاهده شده که زخمها در مدار با سرعت کمتری بهبود مییابند. در واقع مطالعات انجام شده بر روی سلولهای در معرض ریز جاذبه و ابر جاذبه نشان میدهد که سلولهای انسان برای تحریک رشد خود به نیروی جاذبه نیاز دارند. با افزایش یا کاهش نیروی جاذبه، پاسخ عملکرد سلول به صورت خطی تغییر میکند. بنابراین این امر خطرات قابل توجهی برای سلامتی فضانوردان در پرواز طولانی مدت فضایی به همراه دارد.

استفاده از فناوری LED در پزشکی و پیدایش LLLT
در اواخر دهه 1960 که روزهای اولیه استفاده بالینی از لیزر بود، این ترس وجود داشت که انرژی لیزر هنگام استفاده در جراحی و پزشکی باعث ایجاد سرطان به عنوان عارضه جانبی شود. برای ارزیابی این موضوع، در مقالهای که در سال 1968 منتشر شد، پروفسور اندره مستر(Endrè Mester) ، پدر شناخته شده فوتوتراپی از دانشگاه سملویز، دوزهای روزانه از سطوح تصادفی کم انرژی لیزر یاقوت متمرکز را به پشت تراشیده شده موش تاباند. مستر به هیچ وجه تغییر سرطانزایی مشاهده نکرد، اما به طور اتفاقی کشف کرد که LLLT رشد مجدد مو را در حیوانات تسریع میکند. آزمایشهای Mester نشان داد که دلیل این موضوع، سطح بیوی فعالکننده انرژی نور است که به طور همزمان در محیط پیرامون منطقه مخرب فوتورژیکی (photosurgical) وجود دارد.
در دهه 1970، تعدادی از پزشکان، با الهام از انتشار مقاله Mester در سال 1969 در مورد استفاده موفقیتآمیز از LLLT برای درمان زخمهای خشن غیر قابل بهبود یا شکننده، شروع به استفاده از LLLT به صورت بالینی، به ویژه در فرانسه و روسیه کردند. در اوایل دهه 1980،LLLT به ژاپن، کره و سایر کشورهای آسیایی گسترش یافت. با این حال، جهان اصلی علم پزشکی در ایالات متحده آمریکا همچنان به عنوان «جادوی سیاه» به آن نگاه میکرد. اولین تأیید سازمان غذا و داروی FDA (Food and Drug Administration) برای فتوتراپی با دیود لیزر نیز تا سال 2002 صادر نشد.

مکانیسم عمل در درمان با نور کم توان (LLLT)
امروزه اثر بیولوژیکی نور بر کسی پوشیده نیست. اما آنچه باید بدانیم این است که انرژی لیزرها و LEDها چگونه در سطح سلول کار میکنند و پارامترهای نور مطلوب برای استفادههای مختلف چیست.
نیروگاه سلولها در میتوکندری (mitochondria) واقع شده است که قادر به تولید انرژی سلولی یا آدنوزین تری فسفات ATP (adenosine triphosphate) از پیروات (pyruvate) و اکسیژن است. هنگامی که بافتها تحت فشار قرار میگیرند، میتوکندریها، اسید نیتریک میتوکندری (MtNO or mitochondrial nitric acid) خود را میسازند که با اکسیژن رقابت میکند. پس از آن MtNO به اکسیداز سیتوکروم C(CcO or cytochrome C oxidase) متصل میشود و اکسیژن را جابهجا میکند. این امر متعاقباً باعث کاهش سنتز ATP و افزایش استرس اکسیداتیو (oxidative stress) شده که منجر به التهاب میشود. بنابراین بافت هایپوکسیک (Hypoxic) یا استرس در چهار مرحله تحت تأثیر LLLT قرار میگیرند:
- انرژی نور توسط اکسیداز سیتوکروم C جذب میشود.
- اکسید نیتریک آزاد میشود.
- ATP افزایش مییابد.
- استرس اکسیداتیو کاهش مییابد.
این واسطههای بیوشیمیایی بر اجزای سیتوزول (cytosol)، غشای سلولی و هسته تأثیر میگذارند که رونویسی ژن، تکثیر سلولی، نکروز(necrosis) مهاجرت و التهاب را کنترل میکند. سلولهای موجود در خون و لنف نیز، که از طریق نور فعال شدهاند، میتوانند تأثیرات سیستمی ایجاد کنند.
LLLT ابتدا به درمان با منابع لیزر، از جمله لیزر نئون هلیوم (HeNe) با رنگ قرمز قابل مشاهده در 632.8 نانومتر، لیزرهای مختلف نیمه هادی (دیود) (قابل مشاهده از قرمز تا نزدیک مادون قرمز و مهمترین آن GaAlAs در 830 نانومتر) یا اشعههای فوکوس شده لیزر جراحی (به عنوان مثال Nd: YAG یا CO2) محدود شد.
چندین مکانیسم گزارش شده است که نشان میدهد چگونه LLLT میتواند یک اثر زیستتعدیلی را القا کند. در مورد LLLT با منابع لیزر، این اثرات از طریق خصوصیات ویژه مرتبط با ویژگیهای انرژی لیزر، یعنی تکرنگ بودن، جهتگیری یا همبستگی و فوتونها در فاز زمانی و مکانی به صورت آترومیک و آسیب زا، ایجاد میشوند. پدیده دیگری که فقط با انرژی لیزر در ارتباط است، پدیده اصطلاحاً «لکه» است. به عنوان مثال، هنگامی که یک نقطه لیزری670 نانومتری از نزدیک بررسی میشود، به نظر میرسد که از لکههای فوقالعاده روشنتر از انرژی نور تشکیل شده است که به طور مداوم در حال حرکت هستند. اینها لکههای لیزری هستند. لکهها ویژگیهای خاصی از جمله انرژی زیاد و قطبش دارند و این لکههای نور شدید قطبی، با واکنشهای خاصی در هدف جذبکننده (کروموفور) همراه هستند.
LED فرایندهای اساسی انرژی را در میتوکندریها (محفظههای انرژی) ی هر سلول تحریک میکند؛ به ویژه هنگامی که از نور مادون قرمز نزدیک برای فعالسازی مواد شیمیایی حساس به رنگ (کروموفورها و سیستمهای سیتوکروم (chromophores, cytochrome systems)) در پوست استفاده میشود. طول موجهای بهینه LED شامل 680، 730 و 880 نانومتر است. سنتز DNA در فیبروبلاستها و سلولهای عضلانی با استفاده از نور) LED به تنهایی و یا به صورت ترکیبی با ترکیب 680، 730 و 880 نانومتر) در هر 4 ژول در سانتیمتر مربع، افزایش پیدا میکند.
با بیش از 4000 تحقیقات علوم پایه و مطالعات بالینی مطابق با pubmed.gov، LLLT باید به عنوان گزینه اول درمان برای بیماریهایی مانند درد حاد گردن یا کمر، التهاب تاندون، ورم مفصل کف پا، سندرم خفیف تونل کارپ (carpal) و رگ به رگ شدن رباطها در نظر گرفته شود. نتایج استفاده شامل بهبودی سریع، بازسازی بافت، تسکین درد و کاهش التهاب است. از طرفی LLLT توسط خدمات بهداشتی انگلیس و کانادا نیز پذیرفته شده است.
LLLT یک روش درمانی از طریق پوست است و هیچ قسمت تهاجمی ندارد. پزشک، نحوه صحیح تابش لیزر پیوسته یا پالسی، عمق نفوذ، طول موج و توان را تعیین میکند. مدت زمان درمان در محدوده 30 ثانیه تا 30 دقیقه براساس نوع درمان است.
تا پایان دهه 1990، فتوتراپی فقط به منابع لیزر محدود میشد؛ زیرا اگرچه LEDها ارزان بودند، اما دارای قدرت خروجی کم و ناپایدار و باند موج گستردهای بسیار واگرا بودند. به استثنای موارد بسیار کمی، LED های نسل قدیمی، قادر به ایجاد واکنشهای بالینی واقعاً مفید در بافت نبودند. از طرفی تهیه یک LED قرمز آسان بود (خروجی پخششده در حدود 600 – 700 نانومتر) اما تهیه LED در طولموجهای اسمی خاص، به عنوان مثال 633 نانومتر، مشابه لیزرHeNe ، کم و بیش غیرممکن بود.
تولید دیود ساطع کننده نور ناسا (LED)
در سال 1993، دستگاههای کوانتومی (Barneveld ،WI)، یک دیود ساطعکننده نور (LED) برای ناسا ایجاد کردند تا از آن در آزمایشهای رشد گیاهان خود استفاده کنند. این آزمایشها نشان داد که طول موجهای LED قرمز میتواند رشد گیاه را تقویت کند و به طور همزمان و اتفاقی، ضایعات پوستی دانشمندان در این آزمایش به سرعت بهبود یافت. بنابراین فناوری LED که برای آزمایش گیاهی ناسا در فضا ایجاد شده بود، نویدبخش انتقال نور به اعماق بافتهای بدن برای بهبود زخم و رشد بافت انسان شد. فناوری LED همچنین از نظر بیولوژیکی برای درمان فتودینامیکی سرطان اثرگذار است. متعاقباً ناسا شروع به مطالعه استفاده از LED برای افزایش متابولیسم سلولهای انسانی و جلوگیری از نابودی استخوان و عضله در فضانوردان کرد.
به این ترتیب دکتر هریتیویلان، استاد مغز و اعصاب اطفال در دانشگاه ویسکانسین، مطالعه LEDها و لیزرها را با دریافت کمک هزینه از ناسا و مؤسسه ملی بهداشت آغاز کرد. سرانجام در سال 1998، “NASA LED” توسط پروفسور هریویلان و گروهش در آزمایشگاه پزشکی فضایی ناسا تولید شد. این دیود به پزشکان و محققان یک منبع فتوتراپی مفید با واگرایی کمتر، توانهای خروجی بسیار بالاتر و پایدارتر ارائه داد و به موجب شبه مونوکروماتیک بودن (Monochromatic) آن تقریباً همه فوتونها در طول موج یکسان قرار داشتند. این نسل جدید از LEDها همچنین پدیده خاص خود تداخل فوتون را دارند که به موجب آن پرتوهای انرژی متقاطع LED ازLED های جداگانه باعث ایجاد تداخل فوتونی شده و شدت فوتون را به طرز چشمگیری افزایش میدهد. بنابراین LEDهای تولیدی، شدت فوتونی بسیار بالاتر از نسل قدیمی را ارائه داد.
برایLED های ساطعشده با طول موج قرمز قابل مشاهده و نزدیکIR ، به دلیل ترکیب پدیده تداخل فوتون و ویژگیهای پراکندگی نور در این باندهای موج، بیشترین شدت فوتون در زیر سطح بافت هدف دیده میشود. این پدیده به همراه شبه مونوکروماتیک بودن، به این معنی بود که نسل جدیدLED ها منبع بالینی مناسبی برای فوتوتراپی است. از این رو، لیزر درمانی با نور کمتوان توسطKendric C Smith ، فوتوبیولوژیست (Photobiologist) ایالات متحده، به عنوان «نوردرمانی با نور کمتوان» تغییر نام داده شد تا نور LED را نیز در بر بگیرد. بر این اساس، همانطور که توسط ویلان و همکارانش در مطالعات بهبود زخم LED ناسا، نشان داده شد، میتوان واکنشهای زیستی مفیدی را باLED ها بدون گرما و آسیب و از طریق فعالسازی سلولی به دست آورد.
تقویت رشد سلول بدن فضانوردان در ناسا به وسیله LED
آتروفی عضلات و استخوانها به خوبی در فضانوردان ثبت میشود. صدمات مختلف جزئی در فضا تا زمان فرود آمدن بر روی زمین بهبود نمییابد. از طرفی پرواز طولانی مدت فضایی، علاوه بر خطرات ذاتی فراوان خود، احتمال آسیبدیدگی فضانوردان در هنگام انجام وظایف خود را نیز افزایش میدهد. از طرفی این واقعیت که روند طبیعی بهبودی، تحت تأثیر ریز جاذبه منفی قرار میگیرد، باعث ایجاد نیاز به روشهای جدید برای بهبود زخم و رشد بافت در فضا میشود. نور درمانی با استفاده LED در ناسا به طور قابل توجهی مراقبتهای پزشکی را برای فضانوردان در مأموریتهای فضایی طولانی مدت، بهبود بخشید. در واقع زخمها در فضا نسبت به زمین، کمتر بهبود مییابند و استفاده از نور درمانی با LED به افزایش سرعت ترمیم زخم در محیط ریز جاذبه کمک میکند و خطر صدمات قابل درمان را در مأموریت کاهش میدهد.

کاربردهای LEDدرمانی
نوردرمانی با نور کم توان LLLT (Low Level Light Therapy) با تولید نسل جدیدی از دیودهای ساطعکننده نور LED (light-emitting diodes) که میتواند نواحی بزرگ را تحت تابش قرار دهد، در بسیاری از زمینههای بالینی مورد توجه قرار گرفته است. منطق و بنیاد موجود درLED-LLLT بر اساس تأثیر گزارششده از آن در سطح سلولی و زیر سلولی- به ویژه برای طول موجهای 633 نانومتر و 830 نانومتر- استوار است.
استفاده از LLLT برای کنترل درد، اولین کاربرد اصلی آن است. از LED-LLLT برای ترمیم تسریع زخمها، آکنههای التهابی آسیبزا و یاتروژنیک (iatrogenic) و همچنین جوانسازی پوست نیز استفاده میشود. با توجه به کارهای گسترده Rochkind و همکارانش در اسرائیل، فتوتراپی LED میتواند به بازسازی عصب کمک کند؛ بنابراین از آن برای آسیبهای نخاع و انواع مختلفی از اختلالات نوروژنیک استفاده شده است. فوتوتراپی LED در کلینیک دندانپزشکی و برای استخوانسازی مجدد ایمپلنتها و پروتزها در جراحی فک، نیز مورد استفاده قرار گرفته است. در حال حاضر، تحقیقات و توسعه کاربردهای جدید برای فوتوتراپیLED ، به ویژه در فرایند تنظیم سلولهای التهابی، به طور مستمر در زمینه پوست در حال بررسی است.
کاربرد فوتوتراپی LED برای کنترل درد
دردهایی، از جمله درد بعد از عمل، ورم بعد از عمل و بسیاری از انواع التهابها را میتوان با نوردرمانیLED ، به طور قابل توجهی کاهش داد. به عنوان مثال، فوتوتراپی LED 830 نانومتر به طور قابل توجهی باعث کاهش درد حاد و مزمن در ورزشکاران حرفهای میشود.
کاربرد فوتوتراپی LEDدر جوانسازی پوست
یک کاربرد بسیار مشهور از فوتوتراپی LED، استفاده از آن برای جوانسازی پوست و آسیبدیدگی ناشی از نور است. لی و همکارانش، در یک مطالعه کنترلشده تصادفی، نشان دادند که بعد از LEDدرمانی پوست، فیبروبلاستهای (fibroblasts) بررسی شده با میکروسکوپ الکترونی عبوری، فعالتر به نظر میرسند. همچنین بازدارندههای بافتی متالوپروتئینازهای ماتریک (matric metalloproteinases) و از طرفی سنتز کلاژن و الاستین (collagen and elastin) نیز افزایش یافتهاند، در نتیجه آن، جوانسازی مؤثری حاصل شد که تا 12 هفته پس از جلسه درمان نهایی، حفظ شد. امتیازهای رضایتمندی بیمار، این یافتههای هیستوپاتولوژیک (Histopathological) را نشان میدهد. جوانسازی پوست کاملاً بر اساس روند ترمیم زخم، به ویژه نئوکلاژنز (neocollagenesis)، استوار است. همچنین فوتوتراپی LED در پیشگیری از ایجاد جای زخم، بسیار مؤثر گزارش شده است. ریزش مو نیز زمینه دیگری است که در آن فوتوتراپی LED میتواند اثر قطعی داشته باشد.
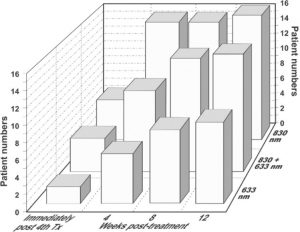
این منحنی، تعداد بیمارانی را نشان میدهد که بهبودی خود را در رتبهبندی 5، بسیار عالی ارزیابی کردهاند. اولین مجموعه ستونها یافتهها را بلافاصله پس از 8 جلسه، دو بار در هفته و به مدت 4 هفته، نشان میدهد. ستونهای 2، 3 و 4 به ترتیب یافتههای هفتههای 4، 6 و 8 پس از درمان هستند. در تمام مراحل، فوتوتراپی LED با 830 نانومتر، رضایت برتر را ایجاد کرده است. این افزایش رضایت در طول دوره پس از درمان جالب توجه است، زیرا نشان میدهد که نتایج از طریق ادامه بازسازی بافت به عنوان بخشی از روند بهبود زخم، بهبود یافته است (داده ها از 24 مرجع اقتباس شده است).
کاربرد فوتوتراپی LED برای ترمیم زخم
تسریع در کاهش درد (به ویژه در پوست) و ترمیم زخم با استفاده از نوردرمانی LED توجه بسیاری را به خود جلب کرده است. گزارشها نشان دادهاند که، پس از ایجاد زخمهای سوختگی یکنواخت با لیزر جراحی، فوتوتراپی LED از زخمهای آزمایشی، باعث ترمیم سریعتر و سازمان یافتهتری نسبت به زخمهای بدون تابش میشود. دلیل آن تأثیر فوتوتراپی 830 نانومتر در افزایش پتانسیل عملکرد سلولهای ترمیمکننده زخم، در هر سه مرحله از فرایند، به ویژه ماست سل ها (mast cells)، ماکروفاژها (macrophages) و نوتروفیلها (neutrophils)، در مرحله التهاب است. در واقع بهبود جریان خون و عروق جدید با LED 830 نانومتر امکانپذیر است. انواع زیادی از سیتوکینها (cytokines)، کموکینها (chemokines) و ماکرومولکولها (macromolecules) را میتوان با نوردرمانی LED القا کرد. در میان کاربردهای بالینی، میتوان زخمهای غیر قابل بهبود را از طریق ترمیم عدم تعادل کلاژنز (collagenesis)/ کلاژناز(collagenase) در چنین نمونههایی بهبود داد، اما زخمهای طبیعی، سریعتر و بهتر بهبود پیدا میکنند. همچنین دردهایی از جمله درد بعد از عمل، ورم بعد از عمل و بسیاری از انواع التهابها را میتوان با نوردرمانیLED ، به طور قابل توجهی کاهش داد.
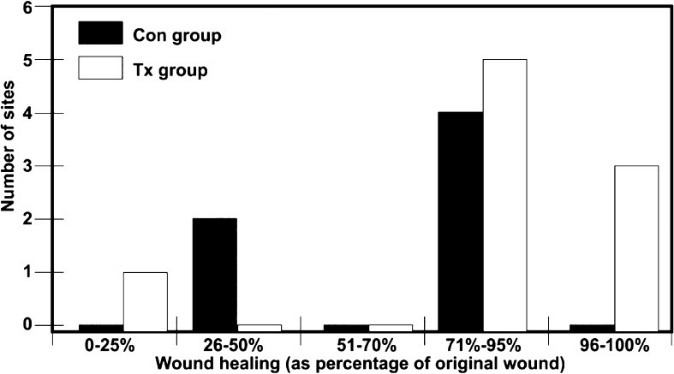
کاربرد فوتوتراپی LED در ارتوپدی
برجستهترین تحقیقات در این زمینه توسط سازمان ملی هوانوردی و فضای ناسا انجام شده است و این مطالعات یک سکوی پرش برای بسیاری از مطالعات دیگر علوم پایه فراهم کرده است. با اینکه تعدادی از مطالعات بالینی فعلی در زمینه ارتوپدی انجام شده است، اما تنها در چند سال گذشته، مطالعات علوم پایه، مکانیسم تأثیر LLLT بر روی سلول و متعاقب آن، ارگانیسم را مشخص کرده است. LLLT جایگزین جراحی ارتوپدی برای آسیبشناسی ساختاری نخواهد شد، اما ممکن است به عنوان یک درمان کمکی برای بیمارانی که به دنبال درمان غیر تهاجمی یا بهبود سریع زخم هستند، مفید باشد.
کاربرد فوتوتراپی LED برای ترمیم زخم
فتودینامیک درمانی (PDT) یک روش درمانی سرطان است که اخیراً به عنوان درمان کمکی برای تومورهای مغزی استفاده میشود. PD شامل تزریق وریدی ماده حساسکننده به نور است که ترجیحاً در سلولهای تومور تجمع مییابد و به بیمار منتقل میشود و سپس ماده حساسکننده به نور را با منبع نور فعال میکنند. این امر منجر به تولید رادیکالهای آزاد و به دنبال آن مرگ سلول میشود. توسعه منابع نوری مؤثرتر برای PDT برای تومورهای مغزی با استفاده از فناوری دیود ساطعکننده نور (LED) گسترش بسیاری یافته است. در واقع این دیود اجازه نفوذ عمیقتر نور تومور و استفاده بهتر از ماده حساسکننده به نور را میدهد.
اثرات سیستمیک نور درمانی با نور کم توان LED (LLLT)
یکی از مزایای LLLT با سیستم LED در مقایسه با منبع لیزر این است که سیستمهای مبتنی بر LED سطح بزرگتری را ارائه میدهند؛ به طوری که میتوانند ناحیه زیادی از بدن را بدون دخالت دست تحت تابش قرار دهند. علاوه بر این، در LED-LLLT، انواع مختلف سلول به طور همزمان میتواند هدف قرار گیرد. این بدان معناست که فوتوتراپی LED احتمالاً تأثیر سیستمیک روی سلولهای التهابی یا ایمنی موجود در بافتهای غیرهمجوار در منطقه مورد نظر و همچنین سلولهای موجود در بافتهای تحت تابش دارد.

فوتوتراپی در حال تبدیل شدن به درمان اصلی
افزایش تعداد مقالات ارائه شده در مورد LLLT در جلسات Photobiomodulation در سال 2010 و به ویژه جلسات 2011 انجمن آمریکایی لیزر در پزشکی و جراحی (ASLMS) گویای این واقعیت است که LLLT به یک جایگاه قابل اعتماد در سراسر جهان دست یافته است. فوتوتراپی LED اکنون به خوبی اثبات شده و در انواع مختلفی از علائم بالینی مانند کاهش درد، بهبود زخم، جوانسازی پوست، برخی بیماریهای ویروسی، رینیت آلرژیک (allergic rhinitis)، سایر شرایط مربوط به آلرژی و … مؤثر است .
اداره داروی فدرال FDA (The Federal Drug Administration) استفاده از LLLT را در سال 2003 تأیید کرد. در برخی از ایالتها، نسخه قبل از درمان اجباری است. درمان میتواند توسط یک درمانگر مجاز، تکنسین رادیولوژی یا پزشک انجام شود. درمانگران ورزش اروپا بیش از یک دهه از LLLT استفاده کردهاند.
آیا فوتوتراپی دیود ساطع کننده نور (LED-LLLT) واقعاً مؤثر است؟
در صورتی که یک سیستم فوتوتراپی LED دارای طول موج صحیح برای سلولهای هدف باشد و چگالی توان مناسب و چگالی انرژی کافی را ارائه دهد، به طور قابل توجهی مؤثر خواهد بود. بر اساس دادههای منتشر شده و تجربه خود نویسندگان، ثابت شده که فوتوتراپی LED کاربردهای روزافزون بیشتری در بسیاری از زمینههای پزشکی دارد. برای تأثیرگذاری، فوتوتراپی LED باید 3 معیار زیر را داشته باشد.
- سیستم LED مورد استفاده باید قبل از هر چیز و از همه مهمتر طول موج صحیح برای سلولهای هدف یا کروموفورها داشته باشد. در حال حاضر، مقالات منتشر شده، شدت 830 نانومتر را برای همه جوانب ترمیم زخم، درد، درمان ضدالتهاب و جوان سازی پوست و ترکیبی از 415 نانومتر و 633 نانومتر برای درمان آکنه ولگاریس(Vulgaris) التهابی فعال پیشنهاد میکند. اگر طول موج نادرست باشد، جذب مطلوب اتفاق نمیافتد.
- شدت فوتون، یعنی تابش طیفی یا چگالی توان (W / cm2)، باید کافی باشد. جذب دوباره فوتونها برای دستیابی به نتیجه مطلوب کافی نیست. از طرفی اگر شدت خیلی زیاد باشد، انرژی فوتون به گرمای بیش از حد در بافت هدف تبدیل میشود و این امر مطلوب نیست.
- دوز تابش نیز باید کافی باشد (J / cm2). اگر چگالی توان بسیار کم باشد، به احتمال زیاد طولانی شدن زمان تابش برای دستیابی به چگالی انرژی یا دوز ایدهآل نتیجه نهایی مناسبی نخواهد داشت.
به شرط برآورده شدن این سه معیار، فوتوتراپی LED واقعاً مؤثر است و جنبههای مفیدی در عمل بالینی برای پزشکان در بسیاری از تخصصهای جراحی دارد.
مراجع:
- Is light-emitting diode phototherapy (LED-LLLT) really effective?, Won-Serk Kim1 and R Glen Calderhead2
Effect of NASA light-emitting diode irradiation on wound healing , H T Whelan 1 , R L Smits Jr, E V Buchman, N T Whelan, S G Turner, D A Margolis, V Cevenini, H Stinson, R Ignatius, T Martin, J Cwiklinski, A F Philippi, W R Graf, B Hodgson, L Gould, M Kane, G Chen, J Caviness
- The NASA Light-Emitting Diode Medical Program – Progress in Space Flight and Terrestrial Applications, Harry T. Whelan, M.D.1a,2,3, John M Houle, B.S.1a, Noel T. Whelan1a,3, Deborah L. Donohoe, A.S., L.A.T.G.1a, Joan Cwiklinski, M.S.N., C.P.N.P.1a, Meic H. Schmidt, M.D.1c, Lisa Gould, M.D., PhD.1b, David Larson, M.D.1b, Glenn A. Meyer, M.D.1a, Vita Cevenini3, Helen Stinson, B.S.3 1a Departments of Neurology, 1bPlastic Surgery and 1cNeurosurgery, Medical College of Wisconsin, Milwaukee, WI 53226, (414) 456-4090 2Naval Special Warfare Group TWO, Norfolk, VA 23521, (757) 462-7759 3NASA-Marshall Space Flight Center, AL 35812, (256) 544-2121
